君たちに伝えたい宮崎の遺産
肝腫瘍に対する手術手技(その1)
メディカルシティ東部病院 肝がん治療センター・外科
東 秀史 先生
肝臓外科は1980年から90年代にかけて飛躍的な進歩を遂げました。その最も大きな要因は、肝離断に際して個々の脈管を意識するようになったことであり、フランスのクイノーがグリソン鞘を意識する手技を提唱したことが緒端でありました。その後、肝静脈の温存によりoutflow blockを避ける手技が定着するに至って、術死率は15%からほぼゼロに低下するという驚愕の結末に至っています。この時代に、宮崎医科大学の肝臓外科は先端的な手術手技を数多く提唱し、30年を経た現在でもその一部が標準的な手技として残っています。
今回は、肝腫瘍の摘出が困難と判断されるケースにおいて、(1)腫瘍と(温存すべき)脈管が近接している場合、(2)下大静脈を遮断しなければ危険と判断される場合の2点に関する(宮崎医科大学で開発された)手術手技を提示します。
巨大な腫瘍が温存すべき肝静脈に接しているケースでは、鉗子を用いた集束結紮やヒートシールなどの方法では手術機器を局所に挿入できないため切除が極めて困難になります。われわれは、腫瘍につながるすべての脈管を超音波メス(CUSA)を用いて掘り出した後で、電気メスで一本ずつ凝固切開(切開の出力を1.2~1.5倍に上げた混合モードであり通常の凝固ではない)する方法を用いています。この方法は、①術野が数ミリと狭くても実施可能である、②断端付近の環境が常に高温にさらされるため局所再発のリスクが低い、そして③CUSAと電気メスの発する振動や組織変化をもとに腫瘍までの距離を判断できる(すなわち、腫瘍から一定の距離を保って切除できる)など、他の方法にはない優れた特徴を有しています。

方法を具体的に示すと、術者と助手はそれぞれCUSAと電気メスを保持しスイッチONのまま切離操作に臨みます。腫瘍組織と脈管本幹を引き離すように牽引すると、腫瘍につながる細い脈管が判別できるようになります。この時、腫瘍の被膜に沿った近接戦(A)または脈管に沿った根治性の高い切除ライン(B)のどちらかを選択する必要があります。この切除線に沿ってCUSAによる肝実質の破砕吸引を行うわけですが、CUSAからの振動を敏感に感じながら、腫瘍被膜あるいは血管壁を正確にトレースしていきます。出現した細い脈管は助手が間髪を入れずに電気メス凝固しますが(Force FXの場合:切開120、凝固60)、明らかにグリソン鞘とわかる場合、あるいは数ミリ以上の肝静脈の場合はヘモクリップや結紮処理にて対応します。
実際の症例を示しますが、肝右葉に10㎝の腫瘍を認め、中間静脈(MHV)は腫瘍にinvolveされています。右肝静脈RHVは腫瘍から少し離れて走行していました。肝予備能が良くないため、左葉と右葉後区域を温存せざるを得ません。切除に際してはCUSAと電気メスを用いて、まず左肝静脈(LHV)の内側枝に沿って切離したのち、後区域グリソン鞘G postを露出してその前面に沿って切離しました。
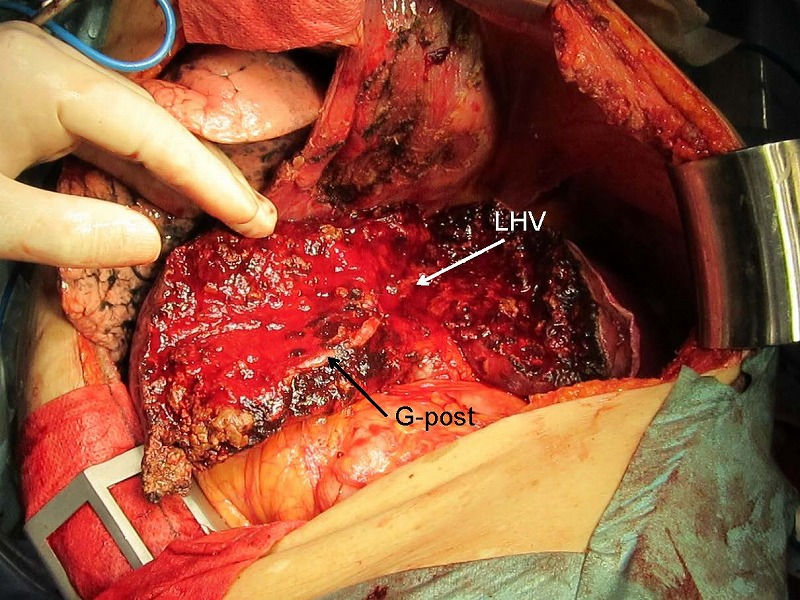
切除後の割面には左肝静脈LHVと後区域グリソン鞘Gpostが見えています。
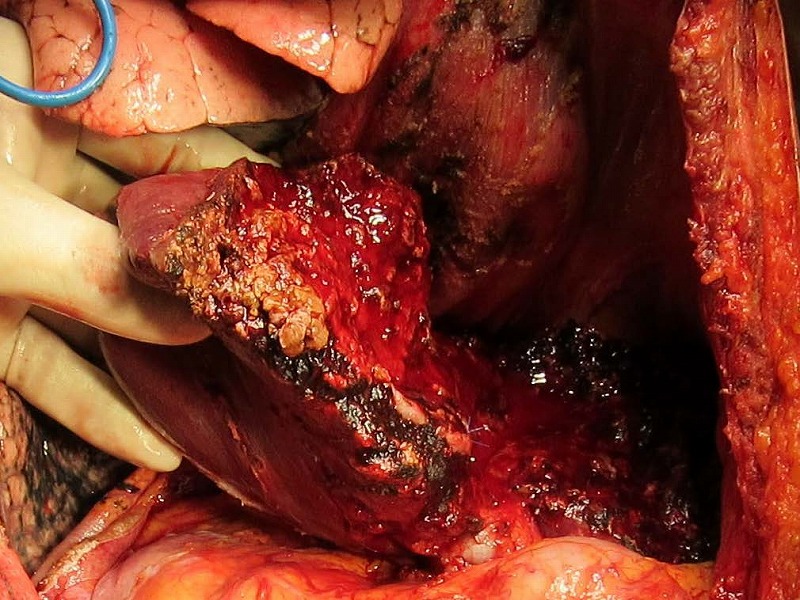
右葉後区域を無理して温存したために重要な脈管に沿った手術操作が延々と続きましたが、電気メスの凝固を多用して結紮操作を少なくしたことで比較的短時間で手術を終えることができました。
次の症例は、尾状葉の8㎝の肝細胞癌です。
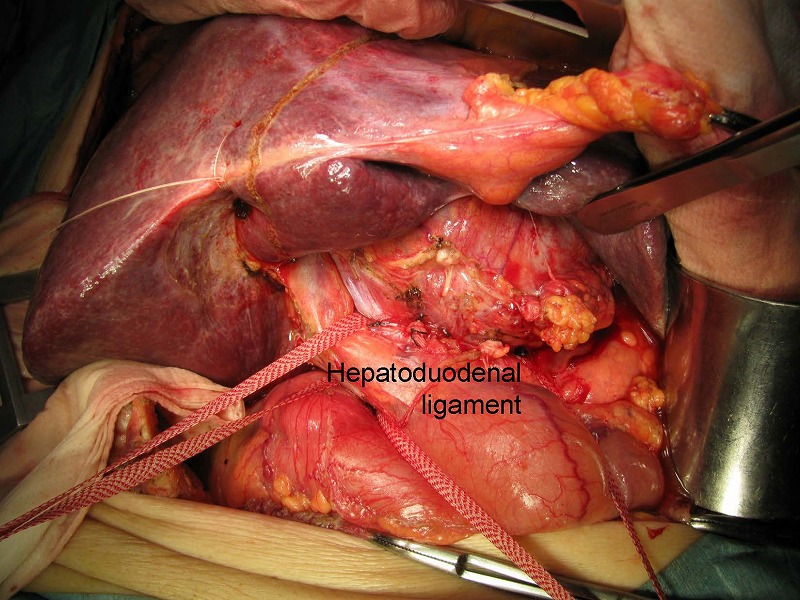
腫瘍の尾側に位置する小網は通常の結紮操作で遊離しました。肝十二指腸靭帯にテーピングしてあります。
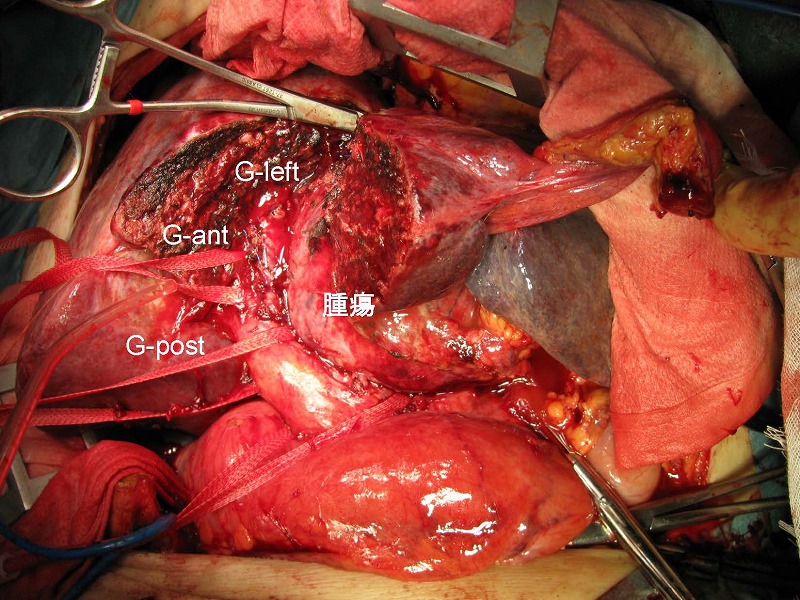
カントリ線に沿って肝離断を行い、肝門部にてグリソン鞘の一次分枝のすべて(右前区域枝G-ant、右後区域枝G-post、および左本幹G-left)にテーピングしました。このテープ群を右葉側に牽引しながらグリソン鞘と腫瘍をつなぐ細い脈管をCUSAと電気メスにて処理しました。この症例ではグリソン鞘本幹に近接して脈管を処理する必要があったため、凝固処理以外にヘモクリップ処理を多用する必要がありました。
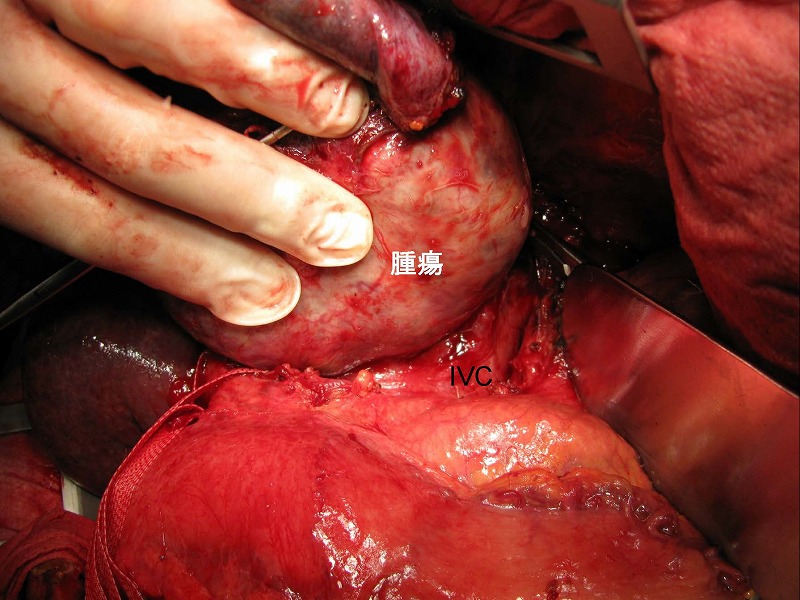
最後に腫瘍と下大静脈IVCとの間隙を剥離しましたが、
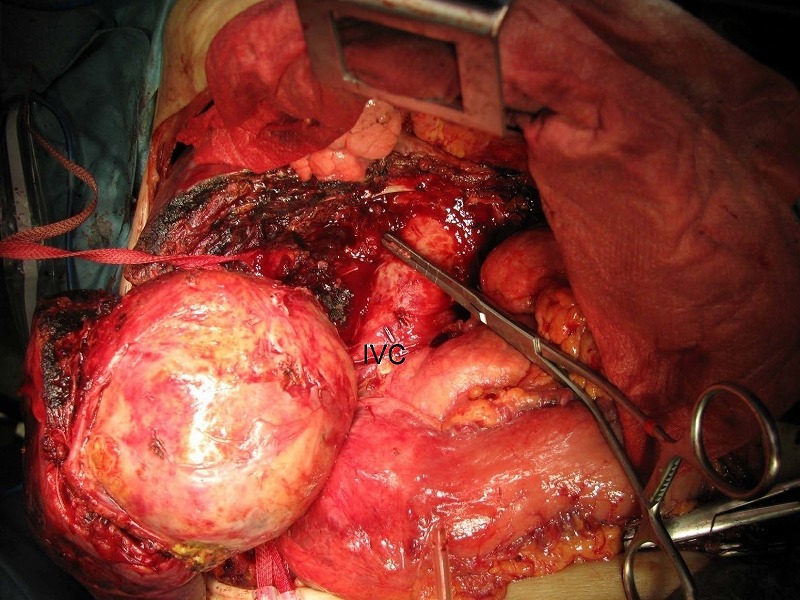
血管鉗子を必要とした静脈は1本のみであり、他はすべて電気メス凝固で対応できました。
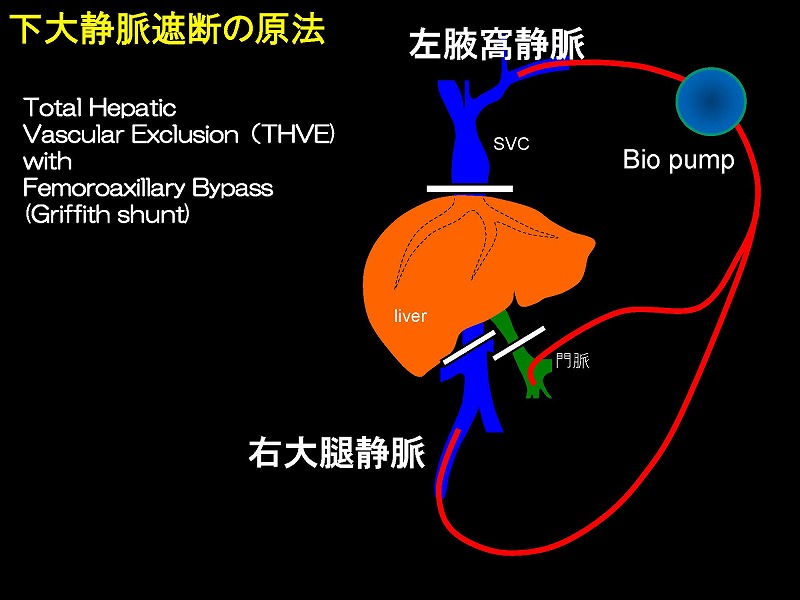
下大静脈遮断は、心臓血管外科の分野で開発され、その後肝臓外科に応用された技術です。肝臓移植におけるTotal hepatic vascular exclusion (THVE)では、肝の上下で下大静脈を遮断しますが、静脈うっ血を軽減するために大腿静脈と腋窩静脈にアンスロンチューブを用いたバイパス(グリフィスシャント)を作成しバイオポンプで駆動する方法をとります。
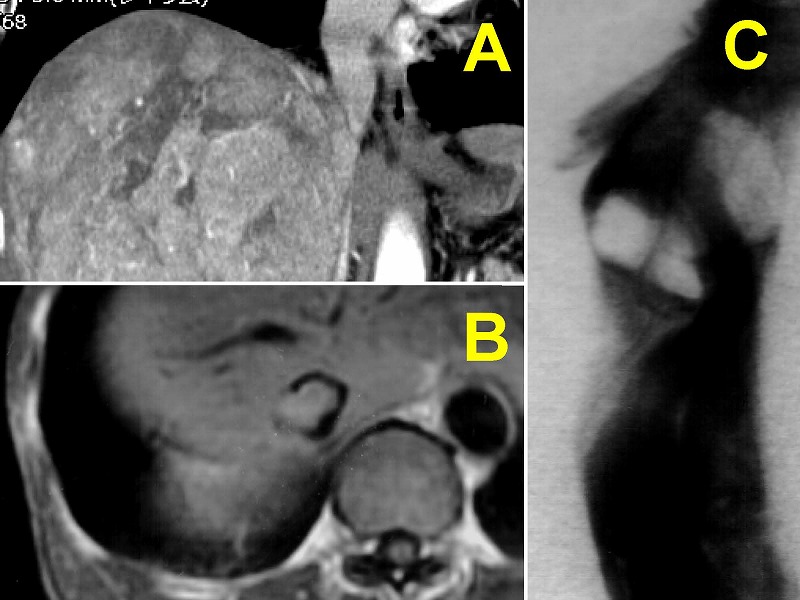
肝腫瘍の手術では、サイドクランプやinternal bypassを用いることが不可能なケースにおいて下大静脈遮断が必要となります。例えば、肝腫瘍が下大静脈まで浸潤している場合(A)や下大静脈腫瘍塞栓形成例B、C)などです。

われわれも当初は肝移植の方法に沿ってバイオポンプを用いていましたが、コストや手技の煩わしさから、より簡便な方法を求めて改良を加えた結果、
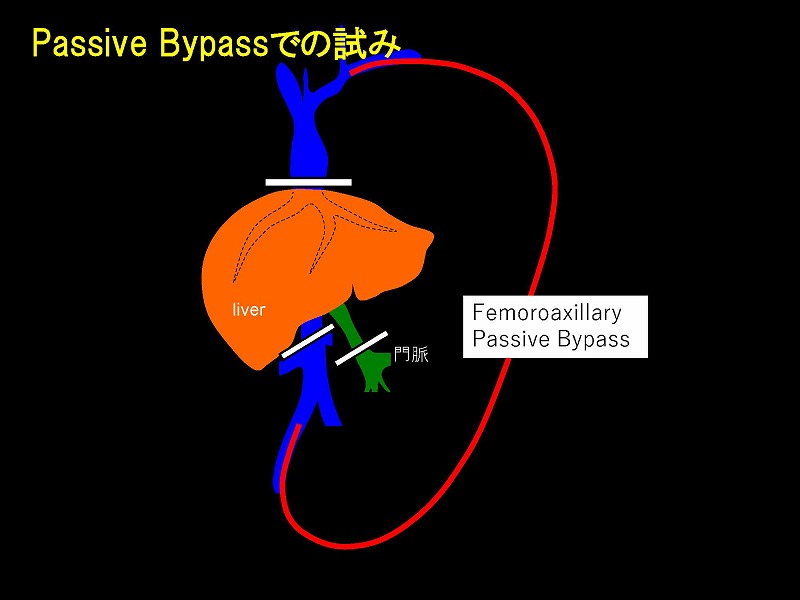
バイオポンプを使用することなく静脈圧格差でバイパス血流を維持する方法(パッシブバイパス法)と、まったくバイパスを行わない方法を完成しましたので提示したいと思います。
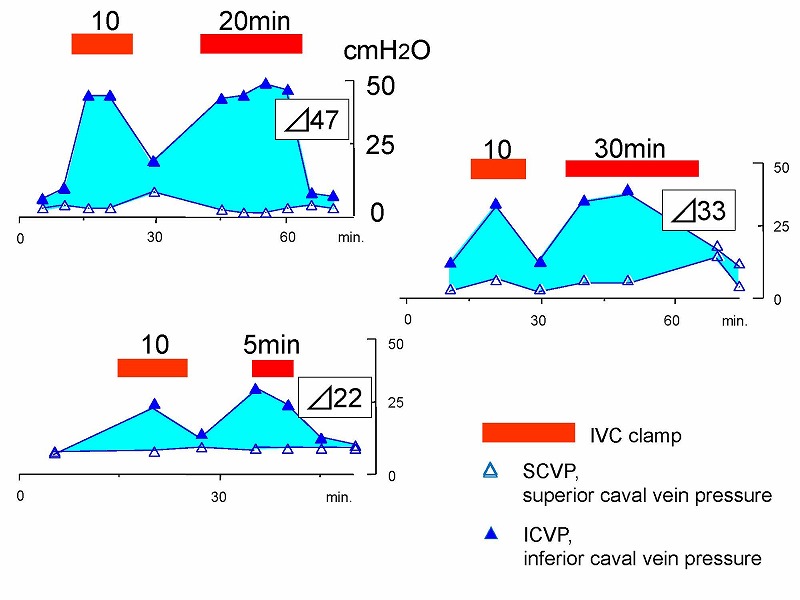
横隔膜付近で下大静脈を遮断した場合、下大静脈圧(ICVP)は上大静脈圧(SCVP)に比べて高い圧を示し、IVC clamp中の両者の圧格差は、最大47㎝水柱圧にも達します。
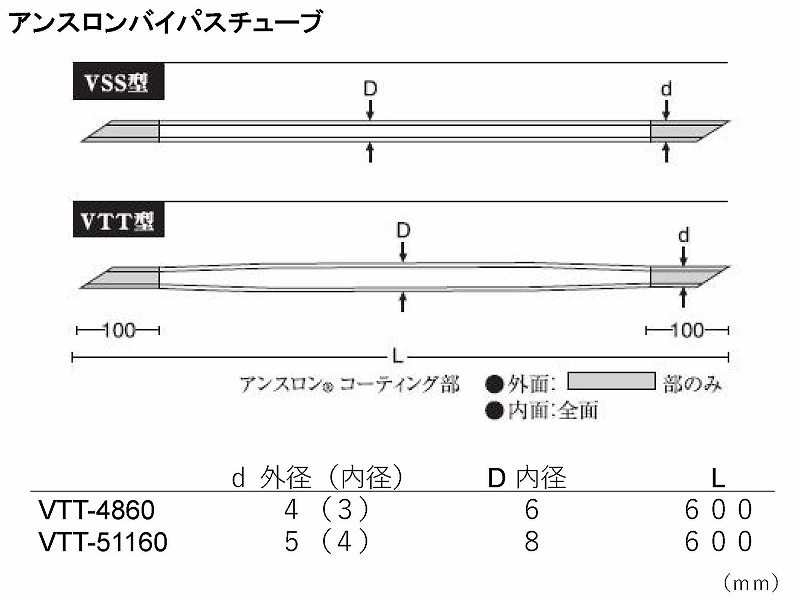
この圧格差を利用したのが最大内径8㎜のVTT-51160型アンスロンバイパスチューブを用いたパッシブバイパスです。
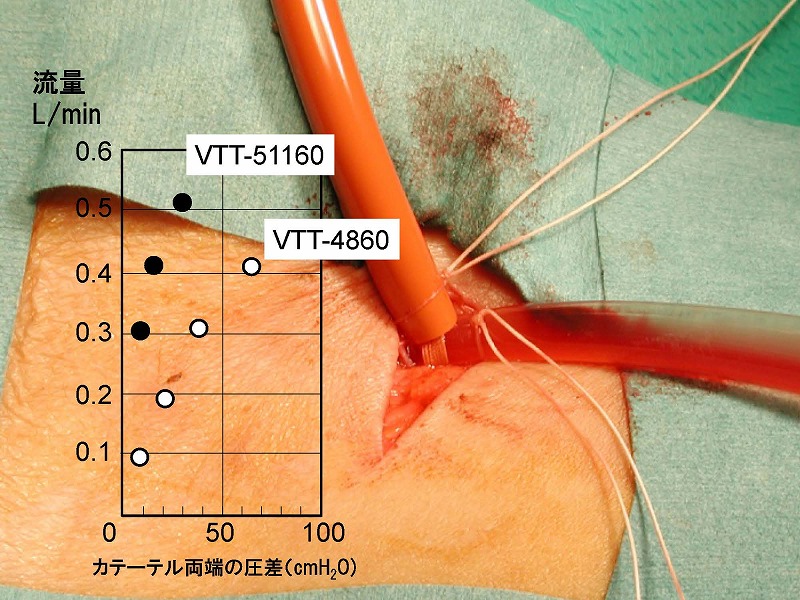
圧格差30㎝水柱圧の場合毎分500mlの流量を確保できることから、煩雑なバイオポンプ駆動が必要ありません。
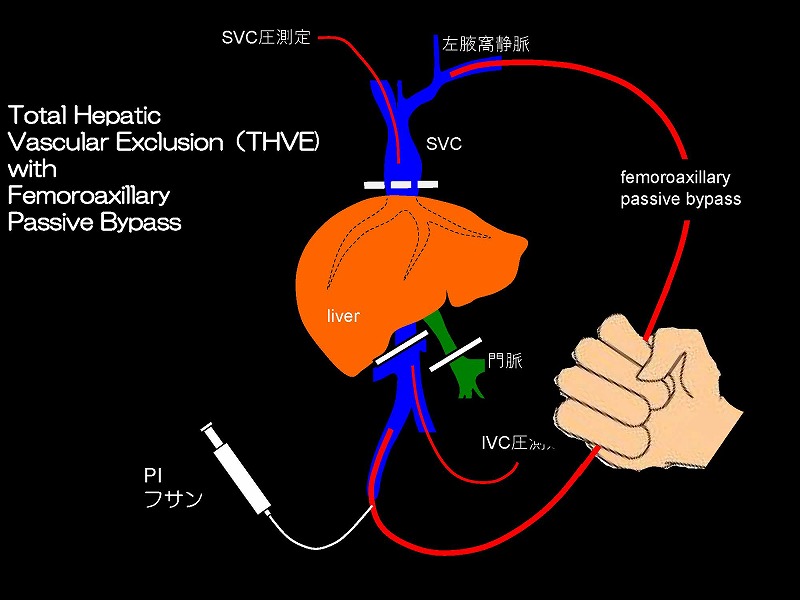
バイパス施行中の回路内凝固事故を防止するためには、フサンを回路内に常時流し、さらに回路の温度を手掌を用いて確認することなどの工夫が発案されました。
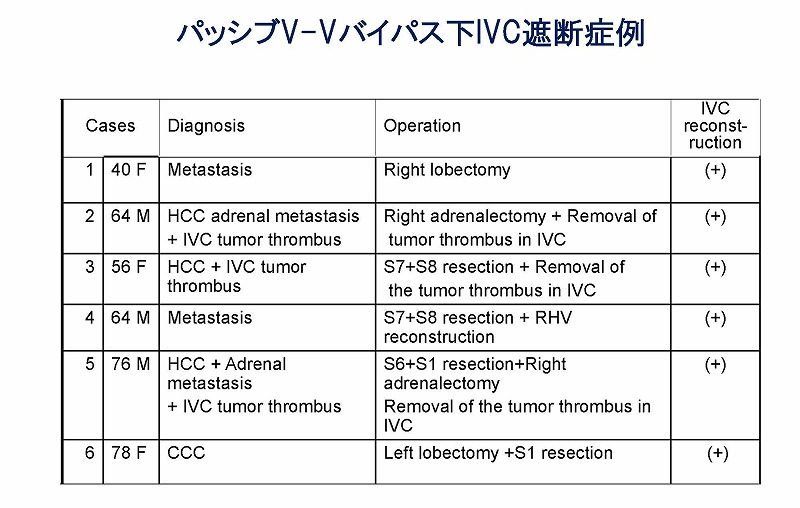
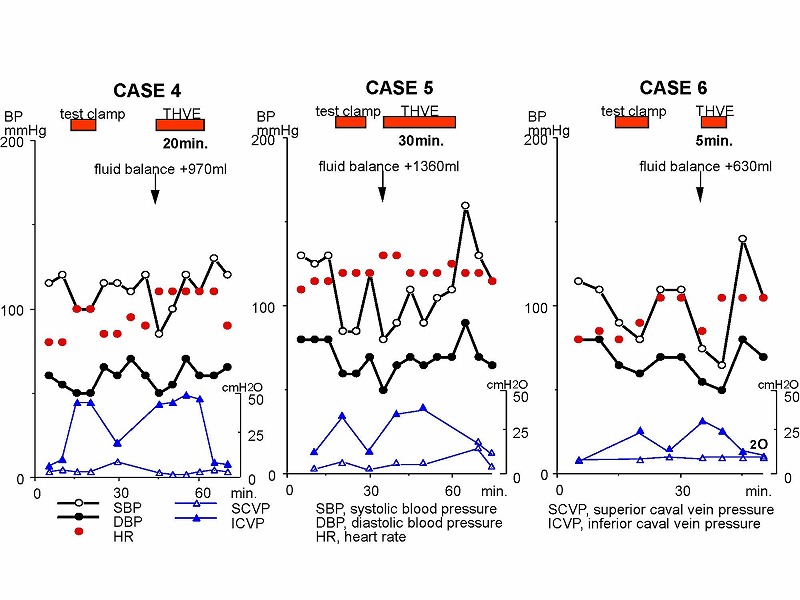
6例の症例においてパッシブバイパス法による下大静脈遮断が安全に行われました。
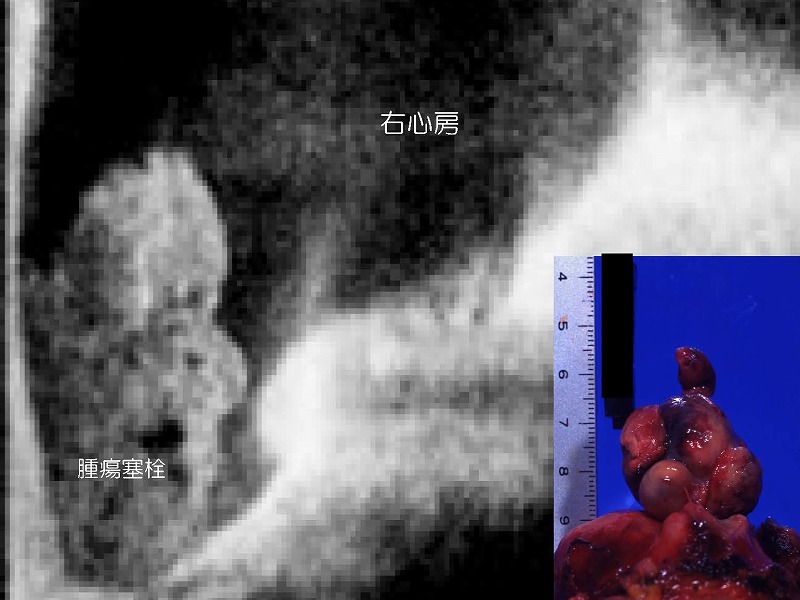
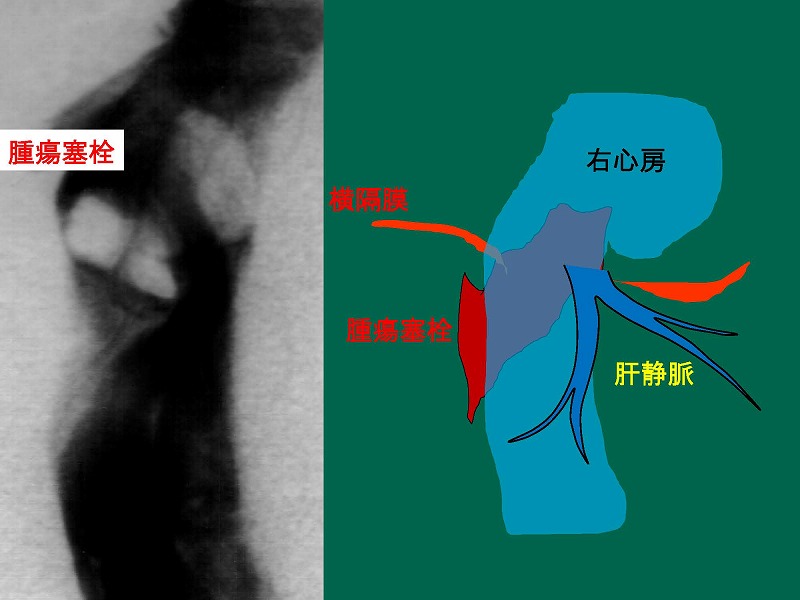
このシリーズにおいて、肝上部で下大静脈を遮断できない症例に遭遇しました。肝右葉の肝細胞癌が下大静脈内に腫瘍塞栓を形成し、さらに右心房内まで進展しているために下大静脈に遮断鉗子をかけることができません。
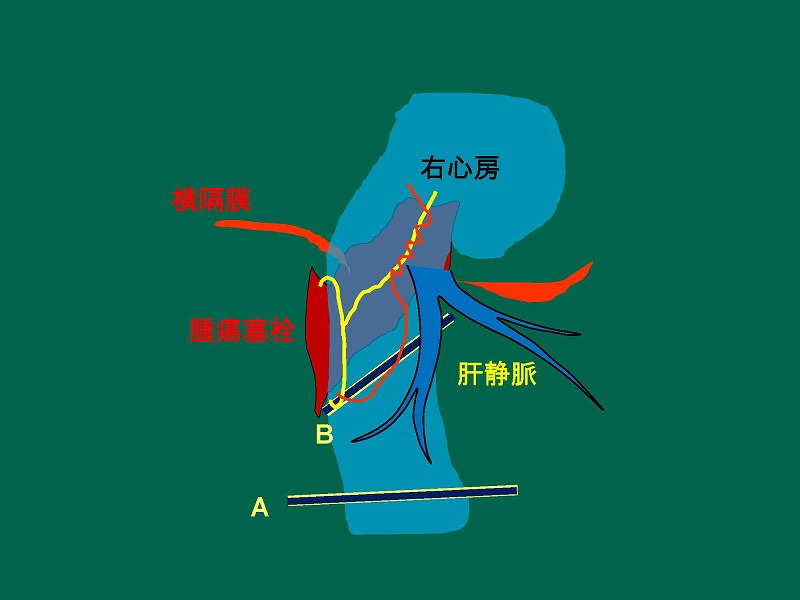
そこで、腫瘍塞栓より尾側の下大静脈にAとBの2本の血管鉗子をかけたのちに下大静脈に黄色の線で示す切開を加えました。右心房側の切開部には赤線で示す血管縫合糸による連続縫合を加えています。心房側の遮断鉗子はなくても、腫瘍塞栓により出血はブロックされていますので特に問題はありません。
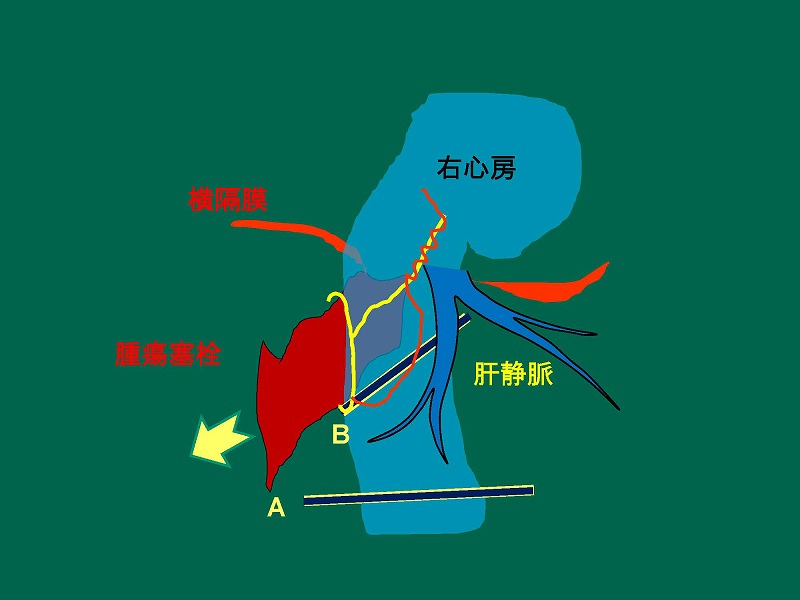
続いて切開線からメッツェンバウム剪刀を差し込み塞栓と血管壁を剥離したのち、腫瘍塞栓を一部引き抜きます。
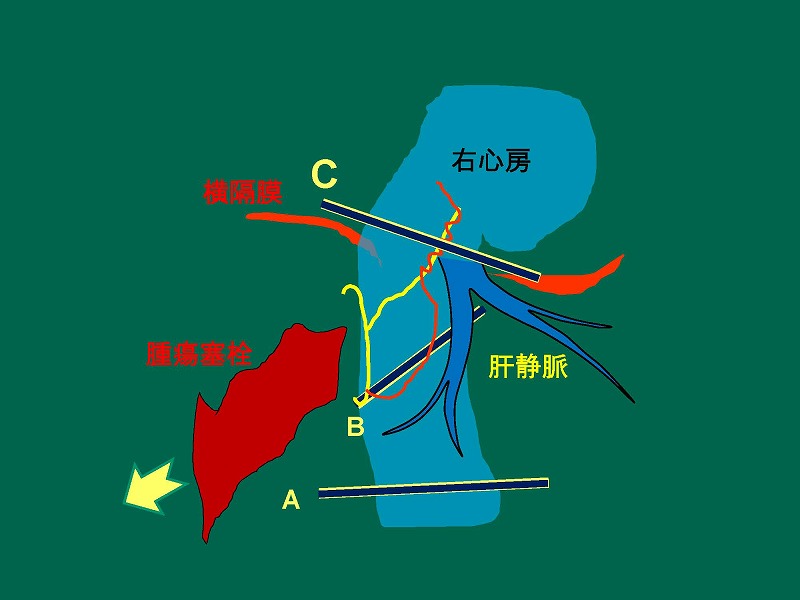
この時右心房からの出血が見られますが、直ちにCの鉗子を右心房直下にかけたのちに塞栓を完全に引き抜きます。先にかけておいた血管縫合糸用いて、下大静脈の切開部を縫合しておきます。
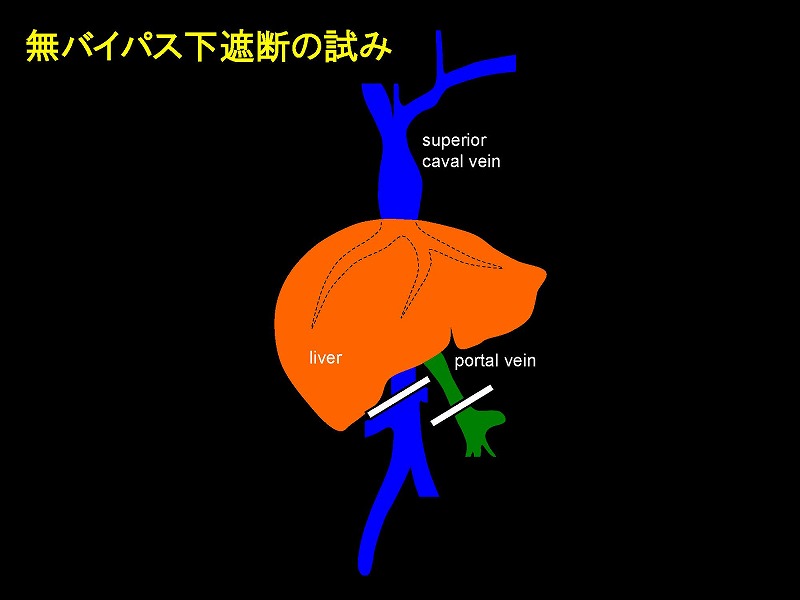
究極の簡易法である、無バイパス下の下大静脈遮断に関するテクニックについて解説したいと思います。図に示すように肝上部でのIVC遮断は必ずしも必要ありませんが、念のためにテーピングだけは行っておきます。。
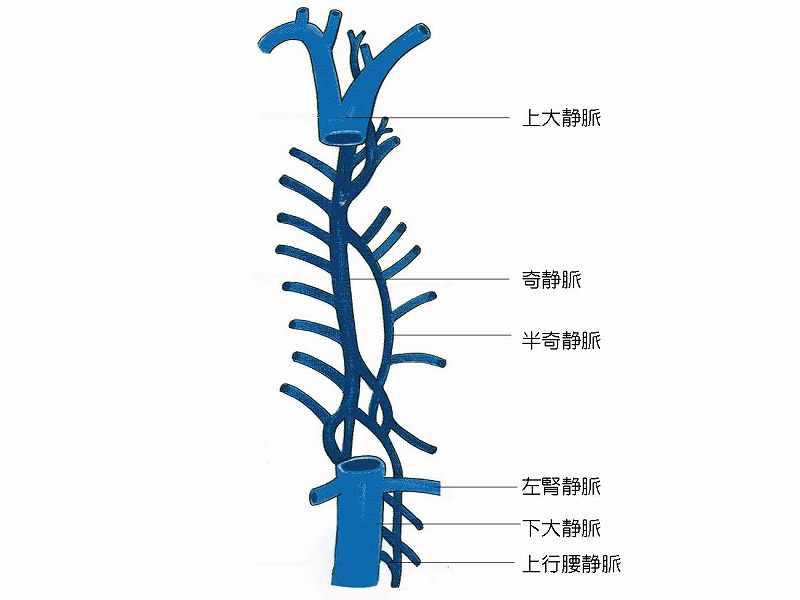
人間においては肝部下大静脈の周囲にナチュラルな側副血行路が形成されていることが知られています。このため、クイノーは75%の個体において肝部下大静脈の無バイパス遮断が可能であると報告しています。
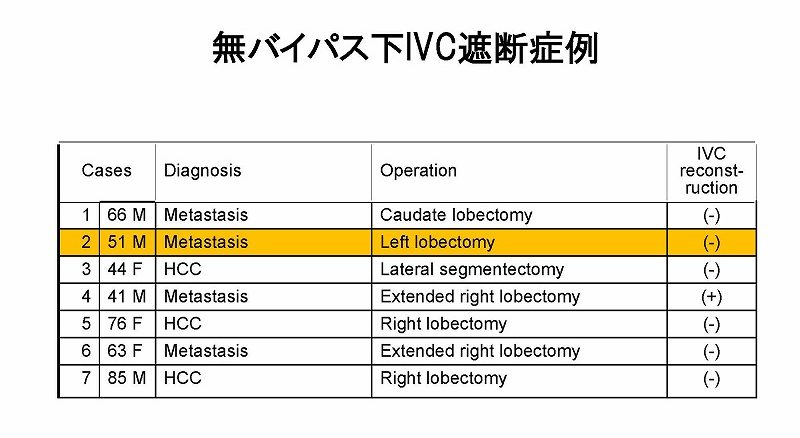
われわれは無バイパス下の下大静脈遮断による肝切除術を7例経験しましたが、この方法で下大静脈再建まで可能であることは今思うと大きな驚きです。
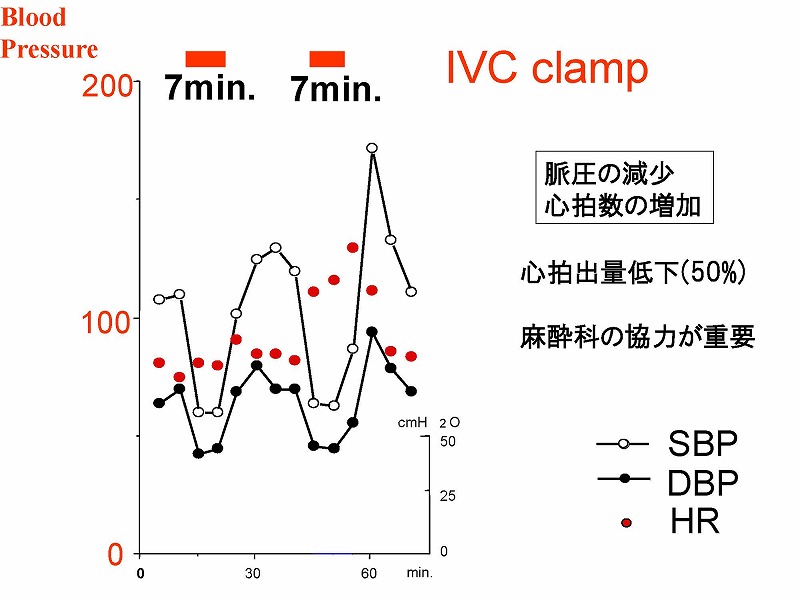
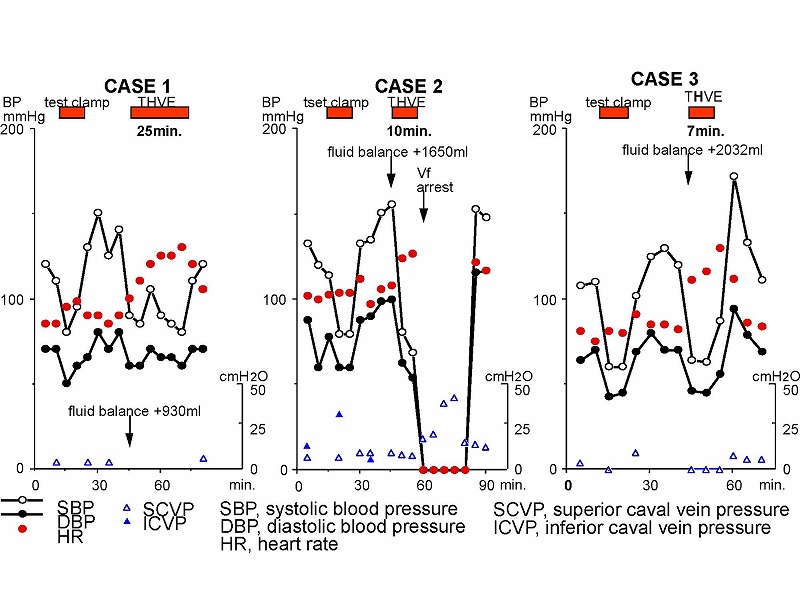
症例3を用いて手術中の血行状態を説明しましょう。無バイパスでの下大静脈遮断では、収縮期血圧(SBP)と拡張期血圧(DBP)のいずれも低下するとともに脈圧も低下します。ただ、自然の側副血行路のおかげで、収縮期血圧の低下は60mmHg前後で止まります。この時の心拍出量は約50%に低下しています。術中心停止のリスクを冒さないためには、麻酔科の協力を仰いで、遮断前に十分な補液をお願いしておくべきでしょう。
7例中6例の術中データをすべてお示しします。5分から30分間の下大静脈遮断が行われていました。症例2では、約20分間にわたって術中心停止が発生しましたが、その後特に問題なく回復し、3週間後には退院可能でした。
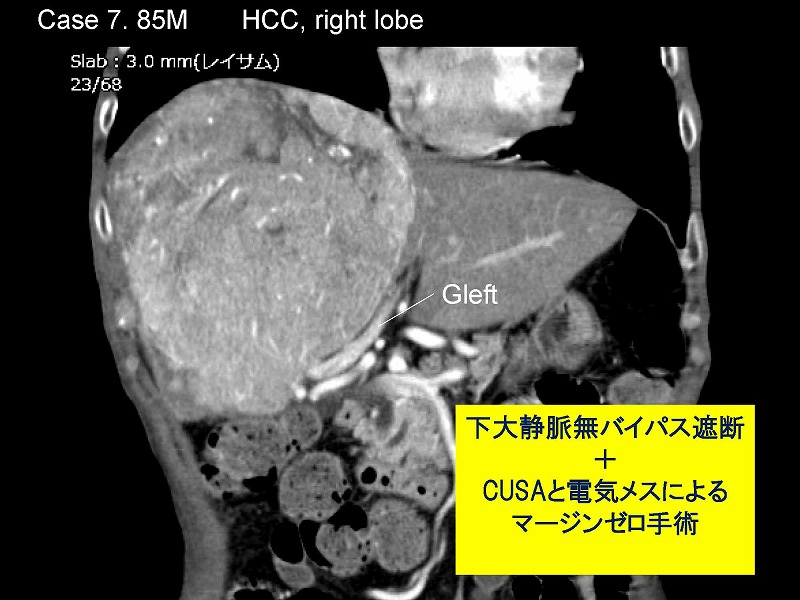
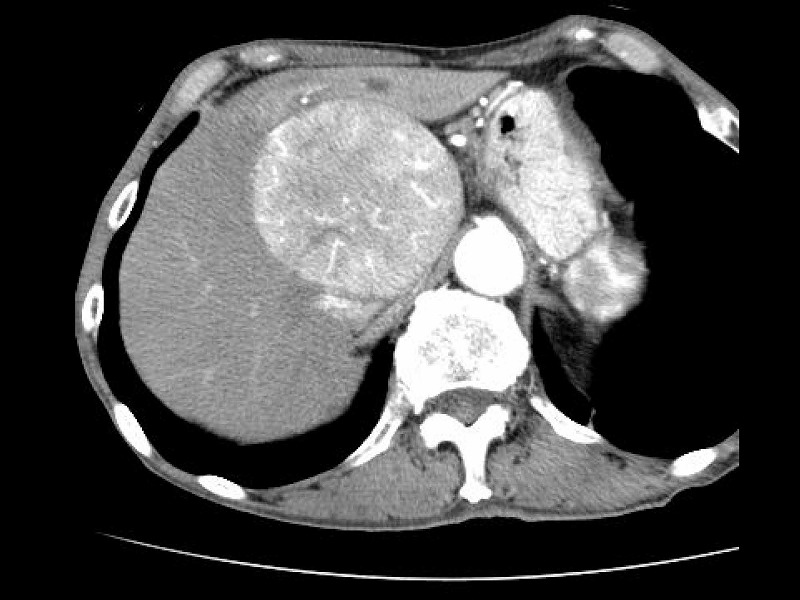
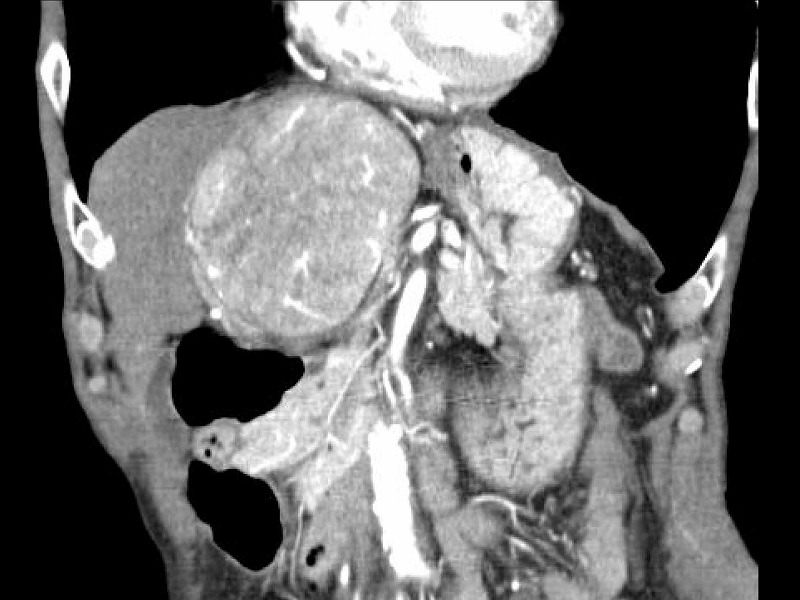
7例目は最初のスライドで提示した症例です。85歳男性の肝右葉に発生した巨大な肝細胞癌が、左葉内側区域を完全に圧迫しています。ICGR15が18%でしたので、拡大肝右葉切除術を避けること、すなわちS4実質を残す方針になりました。
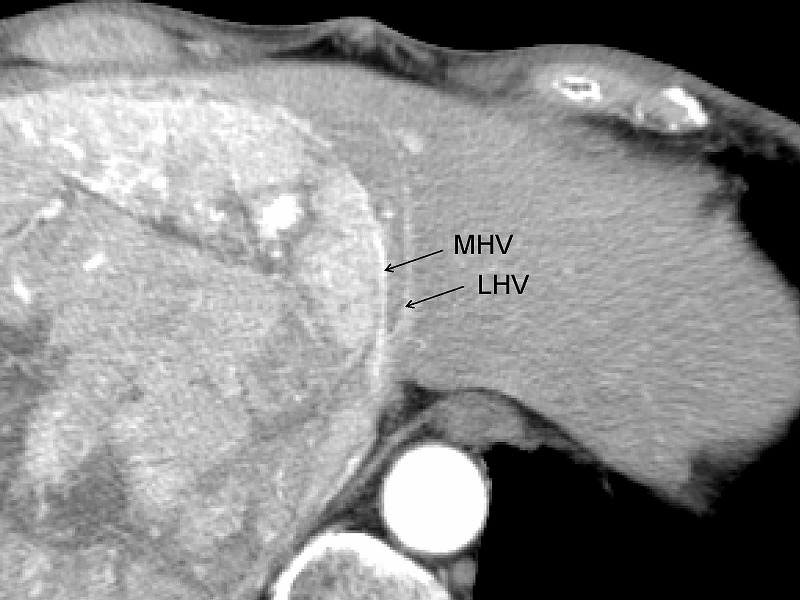
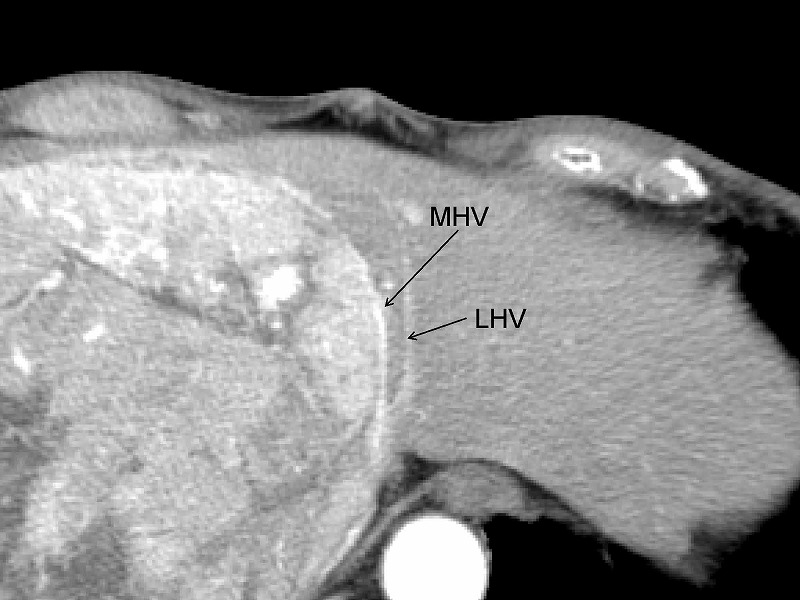
この方針に従うならば、切離戦は必然的に腫瘍と中肝静脈(MHV)の間を通ることになります。この症例では、MHVに沿って肝離断を行うことにしました。例のごとくCUSAと電気メスのみで操作を進めてゆきます。
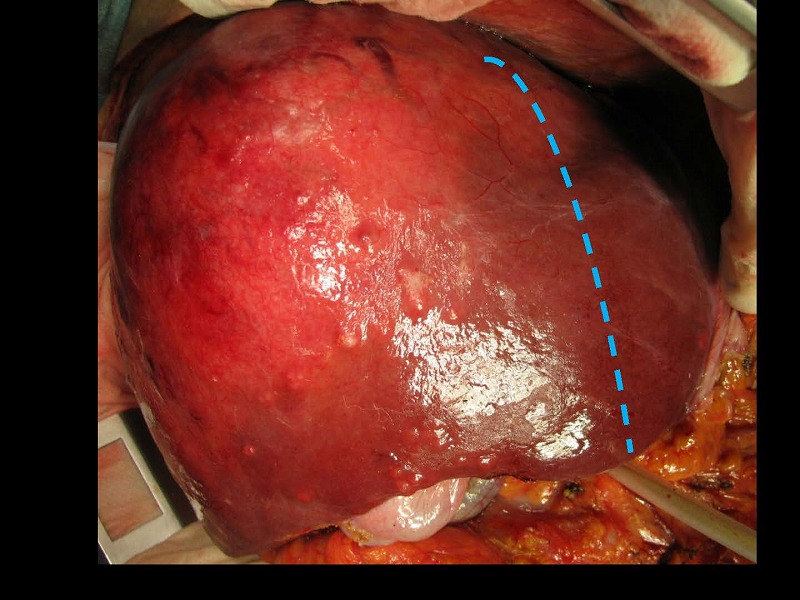
腫瘍をやや右側から眺めたところです。術中エコーを行いながら青い切離予定線に沿って切離を開始します。はじめは腫瘍の被膜を狙って離断を進めていきますが、MHVの枝を確認したら、腫瘍被膜とMHVの間隙を剥離していきます。
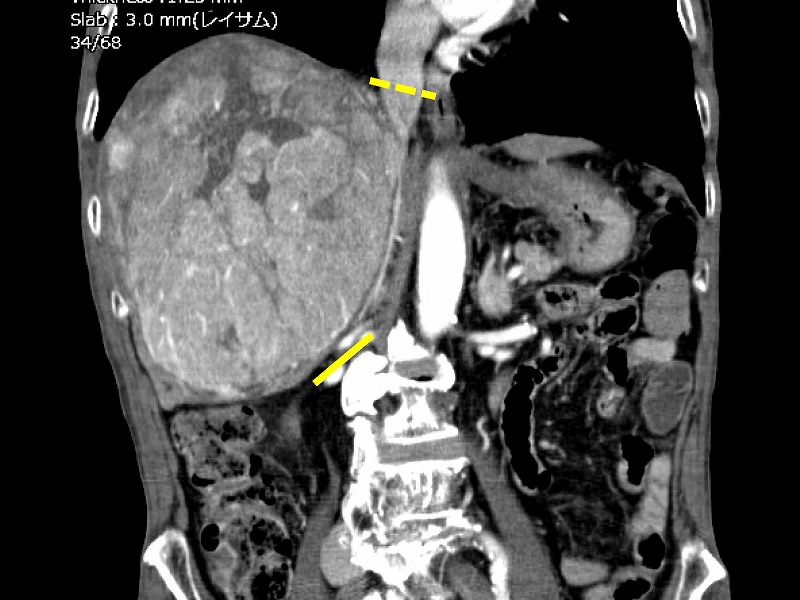
肝切離が尾状葉のレベルに達したのちは、下大静脈へ流入する肝静脈の処理が重要になります。この症例では腫瘍が肝部下大静脈を完全に圧迫していること、さらに腫瘍後面の視野が確保できないことから下大静脈を腫瘍の上下で完全にクランプすることにしました。もちろん無バイパスです。
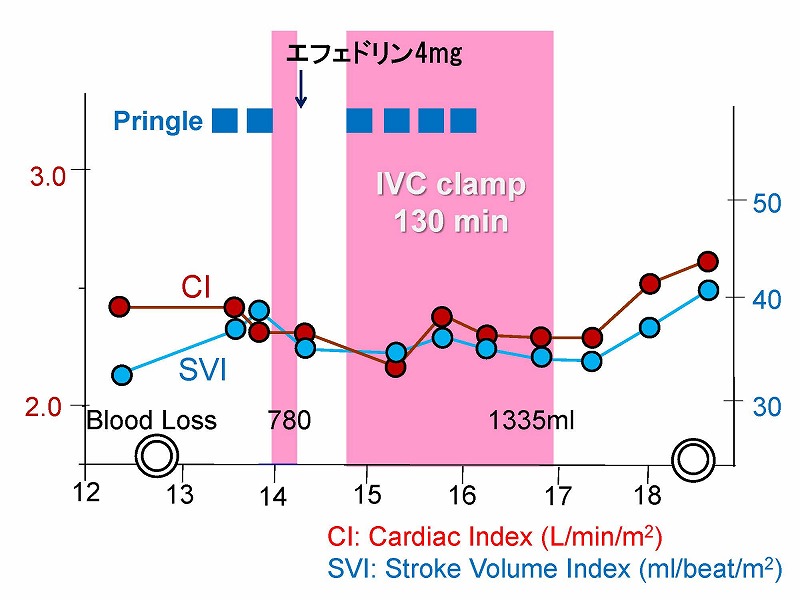
手術経過を示します。手術は12時30分に始まりました。まず15分間のPringle手技による肝阻血を2回行い、腫瘍とMHVの間の離断を終了しました。離断操作が尾状葉のレベルに達したので、下大静脈遮断の準備に入りました。7分間の遮断によるcardiac index(CI)およびstroke volume index(SVI)の低下の程度から遮断は可能と判断しました。500mlの輸液の負荷およびエフェドリン4㎎の投与ののち、130分間の下大静脈遮断を行いましたが、その間に4回のPringle手技下に切除が進められました。17時には摘出が終了し、手術時間は約6時間、出血量は1400ml以下でした。この間、CIおよびSVIの変化は許容範囲で推移しました。
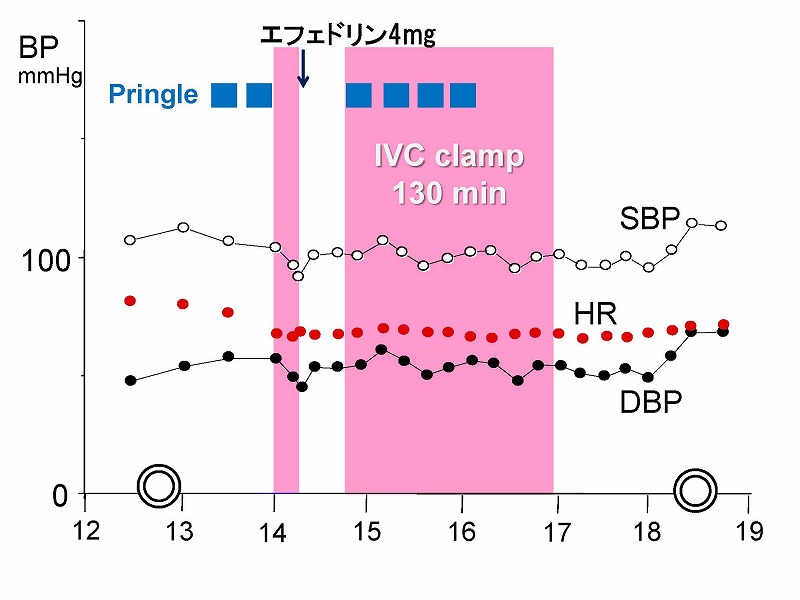
手術中の血圧(収縮期血圧SBP、拡張期血圧DBP)と心拍数HRの変化を見ても、無バイパスとは思えないほど安定していました。
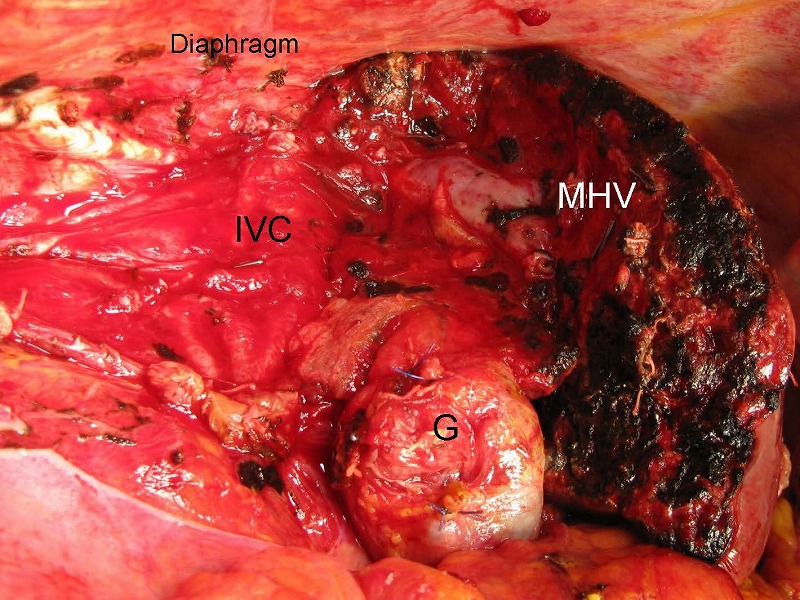
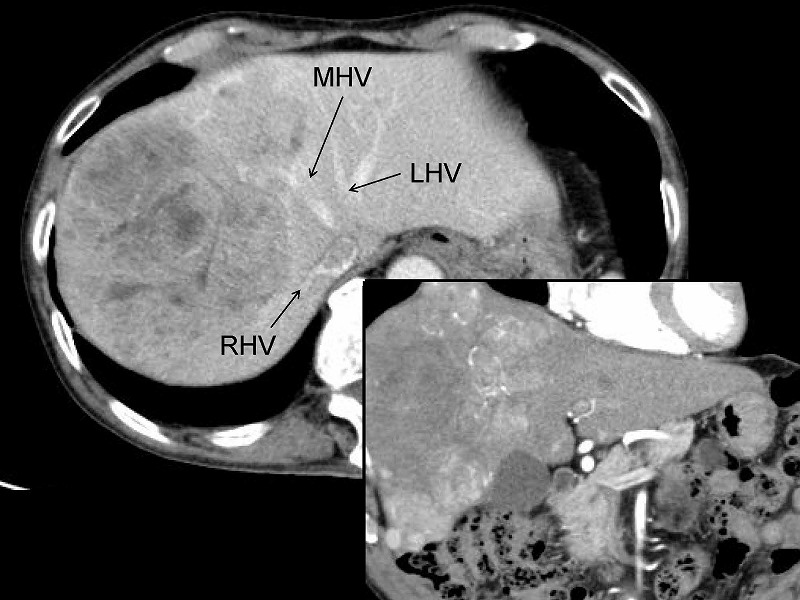
切除後の肝離断面です。完全に温存され拡張している中間静脈(MHV)、中心部に縦に走行して見える肝部下大静脈(IVC)、左枝以外の枝がすべて切断されたグリソン鞘本幹(G)を認めます。脈管処理はヘモクリップで8か所、3-0絹糸による結紮で5か所、4-0プロリン糸による血管縫合で4か所行い、残りはすべて電気メスによる凝固止血でした。
術後の検査データの推移です。白血球数は7PODに12000まで上昇しましたが、2週後には正常値に戻りました。総ビリルビン値およびALTの最大値がそれぞれ1.8および62であることから、この手術の侵襲の低さはご理解いただけるものと考えます。患者は術後2週間で退院しました。術後再発は認めておりません。
今回提示した肝切除術の技術は、1980年代の宮崎医科大学の第一外科時代にほぼ完成したものです。当時は、術中の肝機能を評価するため動脈血中ケトン体比を15分おきに測定するなど極めてマニアックな手術環境であったことを思い出します。その後この技術はメディカルシティ東部病院の肝臓外科で改良されながら生き続けています。地方の貧しい単科大学であっても世界に通用するような技術を創案できるのが医学の世界です。これからの若い外科医たちが常にグローバルな視点で新しい医療(医学)をクリエイトしてくれることを希望します。